Tuz
Tuz Nedir?
1 . Kokusuz, suda eriyen, yiyecekleri korumada ve tatlandırmada kullanılan billursu Madde.
2 . Bir asitteki hidrojenin yerini bir bazın almasıyla oluşan birleşim, Sodyum klorür (NaCl).
Tuz, yani sofra tuzu NaCl dir. Tuz, Asit ile bazın birleşimiyle suyun yanında bir artık madde olarak oluşur. Na ve Cl birleşince oluşur tabii başka versiyonları da vardır. Ama tuzun oluşma prensibi asit artı bazdır. Tuz, bir metal ile bir ametalin birleşiminden oluşan iyonik bir kristal maddedir. Bilim’in dediği gibi NaCl da tuzdur ama sofra tuzunda sadece Na ve Cl bulunmaz, Potasyum ve Magnezyum, hatta az miktarda Calsiyum da bulunur!
Yemek Tuzu
Yemek tuzu, kimyada sodyum klorür (NaCl) ismiyle bilinen beyaz kristal yapılı bir bileşiktir. İnsan dahil tüm canlıların besin kaynaklarından olan tuz, ticari bakımdan da önemli bir maddedir. Dünyanın her yerinde rastlanabilen sofra tuzu tarih boyunca önemli bir ihtiyaç ve ticaret maddesi olmuştur.
Besin maddesi olması dışında tuz; dericilikte, hayvan besiciliğinde, su yumuşatma sistemlerinde ve kimya sanayisinde yaygın olarak kullanılır.
Tuzun İcadı – Bulunuşu
Sofra tuzu doğada, denizlerde çözünmüş halde, kaya tuzu şeklinde ve kurumuş iç denizlerin yataklarında bulunur. Henüz kurumamış tuz gölleri mevcuttur. Memleketimizin İç Anadolu bölgesinde bulunan Tuz Gölü, Lut Gölü ve Amerika’daki bazı göller bu tür göllerdendir.
Tuz elde etme yöntemleri – Tuz Nasıl Üretilir?
Tuz Üretimi – Tuz Nasıl Elde Edilir
Tuz üretimi bütün mineral çıkarma yöntemleri arasında hemen hemen en basit ve kolay olanıdır. Tuz elde etme yöntemlerinin en yaygın olanı, tuzla denilen göletlerde tuzlu suyun buharlaştırılmasıdır. Buharlaştırma yöntemi çoğunlukla kurak ve sıcak bölgelerde uygulanır, bu yol ile elde edilen tuzlarda ticari maksatlar için istenmeyen safsızlıklar olabilir. Yeni elde edilmiş bu tür tuzlarda tuz seven bazı mikroorganizmalar da bulunabilir. Bu mikroorganizmalar örneğin konservecilikte bazı yiyecek maddelerinin bozulmasına sebep olabilmektedir.
Kaya tuzundan da tuz elde edilebilir. Kaya tuzu, önemli tuz kaynaklarından biri olup, içerdiği safsızlıklara bağlı olarak saydam veya yarı saydam grimsi, beyaz, turuncu, sarı, pembe ve kahverengi olabilir. Kaya tuzu, az safsızlık ve yabancı maddeler içeren yataklarda yer altına galeriler açarak parçalar halinde çıkarılır. Çözelti madenciliği olarak adlandırılan bu yöntemde, safsızlıkların fazla olması durumunda açılan sondaj kuyularına sıcak su gönderilirek suda çözünen tuzlar bulamaç halinde dışarı alınır. Bu bulamaçın kristallendirilmesi için tava veya vakum yöntemleri kullanılır.
Kimyada Tuzlar
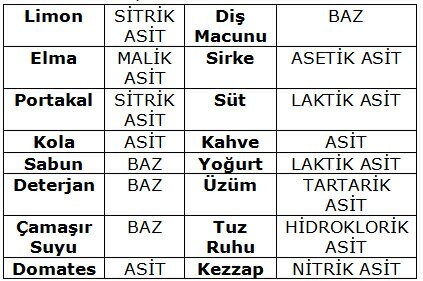
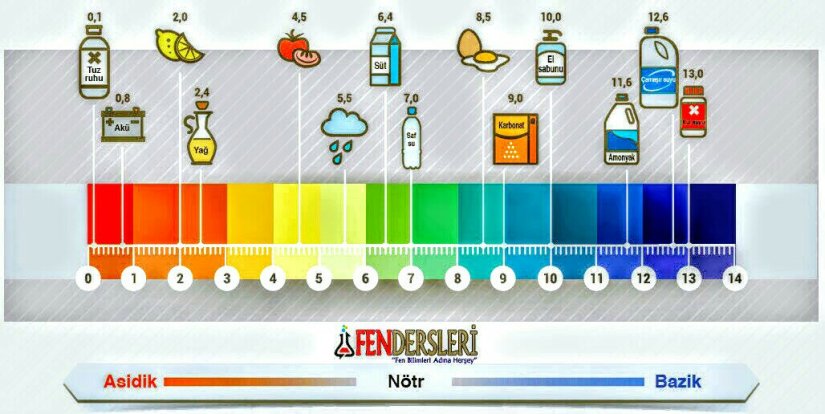
Tuz, kimyada, bir asitle bir bazın tepkimeye girmesi neticesinde meydana gelen maddedir. Tuz bazdaki artı yüklü iyonla asitteki eksi yüklü iyondan meydana gelir. Asitle baz arasındaki tepkime nötrleşme tepkimesi olup bu esnada tuz ve su ortaya çıkar. Erimiş tuz veya çözelti halindeki tuzların çoğu eksi ile artı yüklü iyonlarına ayrışır ve elektriği iletir. Tuz adı ayrıca sofra tuzu veya sodyum klorür (NaCl) için de kullanılır.
Tuzları çeşitli şekilde sınıflandırmak mümkündür. Sınıflandırmanın birisi tuzun bünyesinde OH- veya H+ iyonunun olup olmayışına bağlı olandır. Bu sınıflandırmada tuzlar normal, asidik ve bazik tuzlar şeklinde sınıflandırılır. Normal tuz; tam nötralleşme ürünü olup, meydana getirici asit ve baz kuvvet olarak birbirine denktir. NaCl, NH4Cl, Na2SO4, Na2CO3, Na3PO4 ve Ca3(PO4)2 birer normal tuzdur.
Bazik tuzlar
Bazik tuzlar, bünyelerinde en az bir OH iyonu bulunduran tuzlardır. Suda çözündükleri zaman ortamı bazik yaparlar. Pb(OH)Cl, Sn(OH)Cl ve Al(OH)2Cl’de olduğu gibi. Diğer sınıflandırma metodunda ise, basit, çift ve kompleks tuzlar şeklinde sınıflandırılır. NaCl, NaHCO3 ve Pb (OH)Cl gibi tuzlar basit tuzlardır.
Çift tuzlar
Çift tuzlar iki basit tuzdan meydana gelen tuzlardır. Bunlar suda çözündükleri zaman kendilerini meydana getiren iyonlara ayrışır. Şaplar da çift tuzlar sınıfına girer. Na Al(SO4)2 ve NH4Cr(SO4)2 birer çift tuzdur. Kompleks tuzlar, asit kökü aynı olan iki basit tuzun kompleks kök vererek meydana getirdiği tuzlardır.
K4Fe(CN)6, K3Fe(CN)6, birer kompleks tuzdur. Bunlar suda çözündükleri zaman kendini meydana getiren tuzların iyonlarına ayrışmazlar.
Tuzlar, önce metalin ismi, sonra asidin kökü söylenerek adlandırılır. Na2SO4 = sodyum sülfat, KCl= potasyum klorür, KHCO3 = potasyum hidrojen karbonat (potasyum bikarbonat) gibi.
Bazı tuzlar, kuvvetli asit ve zayıf bazdan veya kuvvetli baz ve zayıf asitten meydana gelmiştir. Bu tuzlar suda çözündükleri zaman hidrolize uğrarlar ve çözeltiyi asidik veya bazik yaparlar.
Tuzların elde edilişi
Asit ve bazların nötrleşmesinden elde edilirler:
BAZ + ASİT ——- Tuz + Su
Metallere asit tesir ettirmekle elde edilirler:
METAL + Asit ——— Tuz + H2
Bazik bir oksite anhidrit tesir ettirmekle elde edilirler:
Bazik Oksit + anhidrid ———– Tuz
Elementlerinden elde edilebilirler:
Metal + HALOJEN ———— Tuz
Metallere baz tesir ettirmekle elde edilirler:
METAL + Baz ——— Tuz + H2
Bazik bir oksite asit tesir ettirmekle elde edilirler:
Bazik Oksit + Asit ——— Tuz + Su
Bir metal(6A grubu) ile ametalin (7A grubu)tepkimesiyle elde edilirler:
Metal + Ametal ———- Tuz